《多肽链》 原创出品
作者|多肽链创始人 严睿
“ZL-1102是我们第一个进入全面全球开发的候选药物。它的概念验证是再鼎医药拥有全球权益的内部研发产品管线开发的重要一步。”再鼎医药创始人、董事长兼首席执行官杜莹博士说。
尽管针对轻中度慢性斑块状银屑病患者的局部治疗药物的ZL-1102尚处在早期阶段,但于成立仅七年的再鼎医药而言,这却是其自主研发创新药物的一个标志性突破。
在10月21日,再鼎医药发布的ZL-1102临床1b期研究结果显示,使用ZL-1102局部治疗轻中度慢性斑块状银屑病患者可改善局部PASI评分、红斑和鳞屑、皮损面积和应答率,并显示出持续的临床改善。
事实上,针对轻中度慢性斑块状银屑病患者,ZL-1102是全球范围内第一个靶向IL-17A的局部治疗药物。因此,再鼎医药表明了对ZL-1102进行全面开发的期待——未来定将其推进至注册临床研究阶段。
正如其创始人杜莹所说,“我们希望尽快将这一创新治疗选择带给需要的患者”。
 再鼎医药创始人、董事长兼首席执行官 杜莹博士
再鼎医药创始人、董事长兼首席执行官 杜莹博士
由一家中国制药公司来做这样一款创新药的全球开发引领,倘若放在五年前都属于足以“震动”行业的事件。毕竟,在创新药研发领域,中国仍然被认为是“落后国”,甚至经常被拿来和印度做比较。
但大环境已经发生了变化。中国在医药产业的发展思路上,正在快速进行“由仿到创”的切换,一系列政策导向都在引导国内药企创新力的提升上。
今年7月间,国家药监局药审中心(CDE)提出的“开展以临床价值为导向的抗肿瘤药物研发”,也被业内认为是提高创新药研发门槛的信号释放。
虽然从医药行业整体发展水平上与欧美国家有相当大的差距,但国内药企中也不乏“冒尖者”,恒瑞医药、百济神州、再鼎医药都可称为中国创新药的代表性企业。
不过,相比激荡五十年的恒瑞医药和院士领衔的百济神州,再鼎医药的开放式创新对于更多中国药企而言,却是个更容易“临摹”的对象。
壹| 解决未被满足的医疗需求
“致力于通过创新疗法的开发和商业化解决肿瘤、自身免疫和感染性疾病领域未被满足的医疗需求”,在再鼎医药的公司简介中有这样一句话。
“未被满足的医疗需求”(unmet medical needs)正是再鼎医药内部关于创新药自主研发策略的一个关键共识。而ZL-1102恰是在这个研发策略下,再鼎于自体免疫领域上的重要落子。
ZL-1102的主要适应症是银屑病。根据IFPA(国际银屑病协会联合会)数据,全球约有1.25亿人口饱受银屑病的困扰。在欧美地区发病率约为2%-3%,美国有800万患者;中国银屑病患病率为0.43%,患者人数超600万。
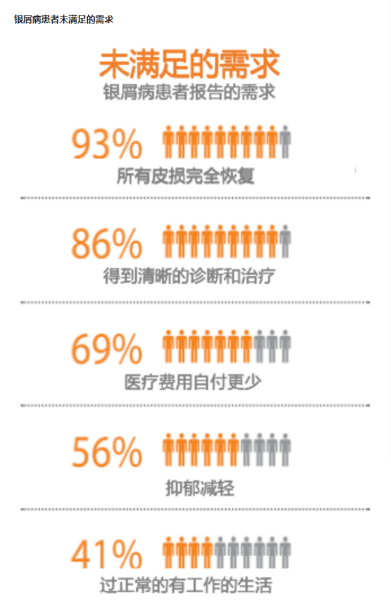
对应患者数据,2019年银屑病药物全球销售收入达165亿美元,而来自EvaluatePharma(医健领域全球市场调研公司)的估算,2024年银屑病药物销售规模预计将达到250亿美元。显然,这是一个充满潜力的市场。
对于银屑病这个国际医学界公认的难题,其实这几年创新疗法也是层出不穷。从TNF-α抑制剂、IL-12/23抑制剂,到IL-17抑制剂等针对不同靶点的生物制剂陆续上市,为治疗银屑病带来了不同于主流复方制剂的新方案。
2019年,诺华、强生和礼来三家跨国药企巨头的银屑病靶向药物在国内获批上市,形成三足鼎立的市场格局。
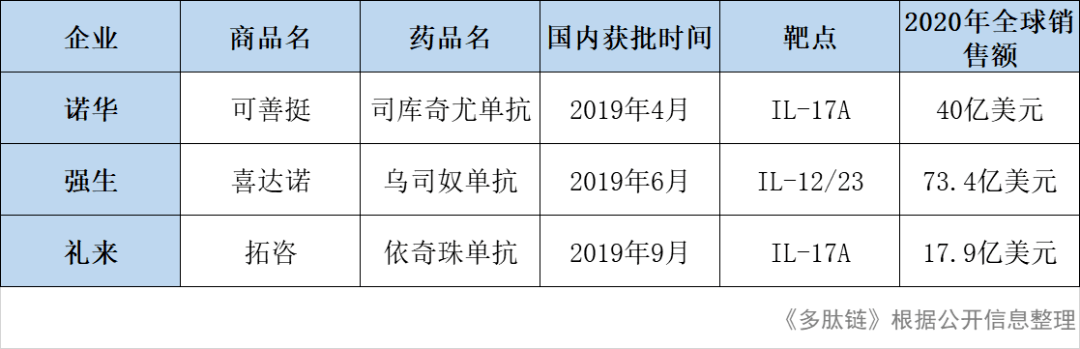
银屑病患者中接近九成都是斑块状银屑病,无论是诺华的可善达、强生的喜达诺、礼来的拓咨,亦或是TNF-α类的生物制剂目前主要针对的是中重度斑块银屑病患者,这部分患者其实仅占比20%-30%。
也就是说,剩下的70%-80%的轻中度斑块银屑病患者,未能被现有的单抗类药物所覆盖和满足。因此,针对基数更大的轻中度斑块银屑病患者群体需求,开发一种能够直接作用于病变部位的局部疗法,便成为了一个开创性的机会。
实际上,与中重度斑块银屑病治疗手段的发展不同,近40年以来,轻中度慢性斑块银屑病的局部治疗一直没能取得突破性进展,目前包括维生素D类似物、皮质类固醇激素、维生素A类似物和地蒽酚等通行治疗方式,均存在各种各样的局限。
现在,再鼎医药的ZL-1102成为全球第一个靶向IL-17A针对轻中度慢性斑块状银屑病患者的局部治疗药物,并且有着明显的临床应用优势。
“我们观察到ZL-1102局部疗法对于轻中度慢性斑块状银屑病患者可快速起效,并有望持久响应。作为一名皮肤科医生,我对这一创新的局部生物制剂疗法感到非常兴奋。”
Epworth医院皮肤科主任、墨尔本大学皮肤科教授、Sinclair 皮肤病医院主任Rodney Sinclair教授表示,从概念验证的研究结果看,再鼎医药的ZL-1102首次证实一种IL-17靶向蛋白可穿透银屑病皮肤并随之产生临床应答。
“这为我们打开了生物制剂给药系统一扇全新的大门。”令Rodney Sinclair教授格外振奋的是,ZL-1102所采用的Humabody®技术,能够直接“敷在”病变的皮肤上,从而避免全身暴露。
ZL-1102的故事还远不止于银屑病,未来再鼎还计划探索更多生命周期管理里的适应症。
贰| 以临床需求和患者为先
回想2019年,跨国三巨头治疗银屑病的单抗制剂可是作为国家药监局第一批临床急需境外新药而引进上市的,再看看再鼎医药如今自研ZL-1102的试验突围,显然这是早有准备的动作!
但令人惊叹的并不在此。要知道,这家定位以患者为中心的创新型全球生物制药公司,是2014年由其创始人杜莹博士在上海张江创办的。七年时间,再鼎医药确如黑马一般显色于行业。
创立仅三年,再鼎医药便登录美股纳斯达克(Nasdaq:ZLAB);2020 年,再鼎医药(09688.HK)又于港交所二次上市。在2020年正式踏入商业化征途后,资本市场也推动了公司的一轮高涨期。
今年初,再鼎医药在纳斯达克和港交所的股价分别达到近200亿美元和1500亿港币的市值规模,成为又一只迈进“千亿俱乐部”(千亿元人民币市值规模)的中国创新药公司。
截至目前,再鼎医药在肿瘤、抗感染和自体免疫领域拥有25个管线资产,包括12个处于临床后期的管线、11个拥有全球权益的自主研发管线,3个产品已在中国上市,5个产品已在美国获批。
公司创办时间如此之短,却能拥有丰富的产品管线,并迅速显露出商业化雄心,放眼医药全行业是极为罕见的,要知道一款药都要往往经历十年以上的上市周期。这得益于再鼎医药“自主研发+外部合作”的双轮驱动创新模式。
授权引进一直是国内外药企丰富产品管线的重要手段。药企借此获得处于不同临床阶段的产品在某一特定区域的研发、生产、和商业化权利。一直以来,再鼎由于其出众的BD能力而为市场所熟知。
去年再鼎医药相继落地国内商业化的三款药品:尼拉帕利(则乐)、Optune(爱普盾)和瑞派替尼(擎乐),正是通过授权引进到中国市场的。

授权引进模式有显而易见的优势。比如,同样的资源条件下,药企可以不受限于自身团队的能力,同时开展多种产品的引进和商业化;再比如,这种操作可以使药企引入产品快速进入市场,甚至可以几乎同步国外新药的产品周期,建立先发优势。
此外,通过授权引进,药企可以获得新药在“自营”区域内的全部知识产权,这既是一种市场竞争的“护城河”,又是自有团队快速“练级”技术实力,构建自主知识产权研发基础的一条路径。
“我们创业之初,结合当时政策环境和国内临床需求,制定了一个短期战略,即通过授权引进模式,从国外快速引进、注册中国临床急需的产品,尽早惠及患者。”
在再鼎医药研究与开发领域首席运营官阎水忠看来,公司的模式可能会根据发展阶段而发生变化,但核心是以临床需求和患者为先来研发创新治疗手段的,“这个宗旨永远不会变”。
事实上,公司创立之初,除了引入国内亟需而在国外已经处于临床后期开发阶段的创新药物,尽快惠及中国患者的短期战略之外,再鼎的核心管理团队还设定了公司中长期发展战略:中期是将自主研发与外部合作的早期产品推向临床;长期目标是所有研发产品进入全球市场。
“每个阶段上的战略目标,都是有机连接的。”阎水忠说。
叁| 药企新贵的创新路
显然,眼下的再鼎医药已经开始了其中期战略的践行。尤其是在自主研发上,不只是ZL-1102,一批早期项目正在与外部合作项目形成梯次储备之态。
2017年,再鼎医药于上海落成研发中心,次年又在美国创建实验室。目前,公司已有7个自主研发的项目,在中国、美国和澳大利亚等国家做临床和研发。
而在今年中期财报中,公司还特意披露了包括IL-17新型人源抗体、人源化IgG4单克隆抗体ZL-1201以及靶向CDC7的ZL-2309三个自研产品的I、II期研究进度。不难看出,再鼎医药对于自身研发团队的能力提升,抱持着的很大的信心。
按照目前的节奏,再鼎未来数年,每年都将至少有1-2个自研产品进入临床阶段。对于快速提升创新药自研能力的再鼎医药而言,专注于为全球患者提供同类首创和同类最优的创新治疗手段,是其自研的发力方向。
可即便外行人也会大抵明白,创新药虽然回报高,但研发周期长、资金投入大,项目失败的概率也很高,徒有情怀是没用的。对于进入关键发展期的再鼎医药而言,唯有踏过商业化的挑战,才能让自研创新药的未来,理想照进现实。
观察再鼎医药2020年度财报,一个显著的变化就是年度内落地商业化的则乐和爱普盾贡献的4900万美元收入,较上一年的1300万美元大涨377%。尽管2020年全年,再鼎医药亏损净额达2.689亿美元,同比放大了38%,但这却大多“亏”在了研发费用端的支出。
按照财报披露,2020年再鼎医药年度研发费用支出为2.227亿美元,这个数字是其当年营收的4.5倍之多,较2019年大增56.6%。正是这种“不计成本”的研发投入,才能够支撑再鼎医药众多管线产品的临床研究。
一边是商业化产品的持续“投产”,一边是外部引进项目与自研管线产品的不断丰富,两手都要抓两手都要硬,是再鼎医药当下的发展状态。

“在研发方面,我们遵循外部合作和自主研发双驱动的策略,希望最大限度的利用外界现有的前沿技术平台,来服务我们的项目,来服务我们的产品,真正满足研发创新的需求。”阎水忠将再鼎医药双驱动的创新药研发策略定义为“开放式创新”。
这一点尤为重要。在当今全球医药研发链条上,越来越多开放的技术研发平台的出现,也成为行业发展的一种趋势性选择。这对于降低医药企业成本与风险,加速新药研发效率和进程,至关重要。
之所以,再鼎能仅用七年时间,就成为全球创新药研发和商业转化成长性最强的企业之一,开放式创新功不可没。并且其还在加速推进与全球各种类型的平台公司合作。
近期,再鼎医药与RubrYc达成合作,进一步加强了抗体研发平台,提高抗体的多样性;与MacroGenics合作就多个包括双抗在内的免疫肿瘤分子展开早期研发合作;与AI企业Schrdinger共同推进在DNA损伤应答领域的药物研发……
不仅是在研发环节,在商业化进程上,再鼎医药同样强调开放式创新。公司与疾病检测、保险、互联网等上下游产业链企业,就赋能肿瘤精准治疗、创新支付手段、提升药品可及等方向展开合作。
“我们愿与行业合作伙伴一起,整合各自优势资源,在从研发至商业化的全产业链展开合作,缩短新药研发周期,加速产品获批、推动药物可及,最终造福全球患者。”再鼎医药首席商务官兼大中华区总裁梁怡如此表示。
笔者后记
全球医药研发,已经从寡头割据的大工业时代迈向专业化分工、智慧化研究的数字时代。市场也在对传统的药研方式进行重构。
来自Drug Discovery Today(《今日药物开发》)今年9月的一项基于超16万个统计数据的分析结果显示:14家全球药物研发领先企业,在1999年-2018年的20年间,研发出270个新分子实体(NME),而其中41%来源于并购,19%来源于药品许可,40%来源于专利研究。
不难看出在更为成熟欧美医药市场,直接并购、授权引进的方式早已是司空见惯的合作方式,而这也是处于由仿创结合向创新引领转变的中国药企的新机会。“走出去,引进来”并非简单的创新药研“选品”过程,而是要进一步针对中国特定适应症的做研究和再开发。
我们观察到,在全球肿瘤和神经疾病适应症等领域,再鼎医药的多个合作开发项目其实都是在引领这些研究的设计,先在中国做概念性验证,成功之后再进行全球开发的。
扫描高举创新药旗帜的中国药企,各家有各家独特的发展路径。恒瑞医药基于本土的自研体系,百济神州向外技术输出的发展模式,以及复星医药并购为重的打法,各有千秋,但是若以再鼎医药的发展视角看,我们认为其所采用的“开放式创新”,无疑为中国药企的创新发展带来了新的启示。
当然,说到底,我们还是更希望看到中国创新药企能够在关键性治疗技术的自研上,不断取得突破,甩掉创新药研“落后国”的帽子,真正成为全球市场的引领者。这一天或许还远,但终将实现。





